![]()
© 1998 Институт химии растворов РАН
Получено 17.01.98 г.
Методами термодинамики показана возможность ориентации низкомолекулярных соединений и дополнительной диссоциации ассоциированных жидкостей. Рассмотрена возможность использования данных процессов в текстильной промышленности.
Ранее было теоретически обосновано и экспериментально показано [1], что ассоциированные низкомолекулярные соединения (НМС) диссоциируют в присутствии полимеров и поверхностей раздела фаз. Поскольку ассоциированные НМС, такие, как вода, перекись водорода, применяются во многих процессах обработки и при использовании текстильных материалов, например, при стирке тканей, то понимание данного процесса может привести к увеличению эффективности технологических процессов.
Основной физико-химической причиной возникновения дополнительной диссоциации является различие избыточных комбинаторных энтропий смешения молекул различных размеров (атермальные растворы) для растворов цепей в ассоциированном и неассоциированном растворителе. Напомним, что данная составляющая изменения свободной энергии образования раствора является одной из главных [2].
Изложенный выше вывод можно получить, используя любую из существующих теорий растворов цепных молекул (см., например, работы [3-5]).
В приближении Флори-Хаггинса [6, 7] избыточная свободная энергия смешения Gи для атермального раствора может быть записана в виде (1):
![]()
где: fi - объемная доля i-того компонента, хi - его мольная доля, ri - число мест в квазирешетке, занимаемых i молекулой, при условии, что наименьшая молекула (обычно растворитель) занимает в ней одно место.
Для растворов цепных молекул (полимеров) в неассоциированной жидкости избыточная свободная энергия смешения молекул различных размеров (GиH) может быть выражена уравнением (2), а в ассоциированной жидкости (Gиa) - (3):
где: n - число молекул растворителя в
ассоциате;
m - характеризует увеличение числа мест,
занятых цепной молекулой в неассоциированном
растворителе по сравнению с числом мест в
квазирешетке при ассоциации растворителя;
N1 и N2 - концентрации молекул
неассоциированного растворителяи полимера,
соответственно;
r1 и r2 - число мест в
квазирешетке, занимаемых, соответственно,
молекулами растворителя и полимера.
Так как 1<m<n, то ![]() G=GиH - Gиa<0
G=GиH - Gиa<0
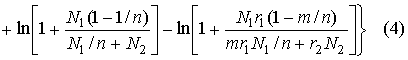
Как видно из уравнения (4), эта составляющая изменения свободной энергии может иметь достаточно большое значение (по абсолютной величине) и, как указывалось выше, вносит существенный вклад в общую свободную энергию образования раствора, что и способствует дополнительной диссоциации НМС в присутствии цепных молекул. Уравнение (4) целесообразно использовать только при относительно небольших молекулярных массах (М) цепей. При больших М, а следовательно, и больших r2 всеми слагаемыми в скобках, кроме первого, можно пренебречь.
При количественной оценке константы равновесия диссоциации НМС (К) нужно учитывать и вклад других составляющих свободной энергии образования раствора. Например, свободная энергия идеального смешения будет возрастать при увеличении числа молекул в системе, что также способствует диссоциации. При увеличении числа молекул, обусловленном дополнительной диссоциацией, в общем случае возрастает объем раствора (в разбавленных растворах составляющей изменения свободной энергии, связанной с изменением объема системы, можно пренебречь), что также приводит к увеличению энтропии, а следовательно, способствует диссоциации. Некоторое, относительно малое значение энтропии, обусловленное комбинаторикой расположения ассоциированных и неассоциированных молекул вокруг цепи (на поверхности раздела фаз), уменьшает дополнительную диссоциацию НМС.
Очевидно, что при увеличении числа компонентов раствора вывод о возможности дополнительной диссоциации останется неизменным, хотя количественные характеристики могут существенно измениться.
Естественно, К будет зависеть и от различия во взаимодействии ассоциированных и неассоциированных молекул растворителя между собой и с цепными молекулами. В большинстве случаев неассоциированные молекулы обладают более сильным взаимодействием, что в соответствии с более точной термодинамической моделью И.Пригожина [5], учитывающей и избыточную энтропию смешения по П.Флори, должно вести не только к увеличению диссоциации, но и к ориентации молекул растворителя вблизи цепных молекул при ассиметричных молекулах и более плотной упаковке вокруг цепи сферических молекул.
При несимметричности неассоциированных молекул растворителя наибольшее различие в соотношении между размерами цепи и растворителя будет при сравнении контурной длины цепи с минимальным размером растворителя. Поэтому максимальная избыточная энтропия смешения молекул различных размеров проявится в случае расположения молекул растворителя вокруг цепных молекул наиболее узким сечением. Если молекулы растворителя имеют три различных размера, то они будут повернуты определенным образом относительно оси цепи. Наиболее вероятное расположение молекул растворителя вокруг цепи реализуется тогда, когда цепь окружает максимально возможное количество молекул растворителя. Естественно, речь идет о размерах сечения молекул, которые могут контактировать с цепью. При оценке ориентации молекул растворителя необходимо учитывать, что при ориентации теряется часть энтропии, обусловленная потерей числа состояний, связанных с различным расположением молекул растворителя в пространстве. Однако эта составляющая обычно значительно меньше, чем избыточная комбинаторная энтропия в случае ориентированных молекул. Обоснование возможности ориентации НМС можно получить, используя вышеприведенные уравнения, аналогично доказательству возможности дополнительной диссоциации.
При количественной оценке ориентации, как обычно, необходимо учитывать все составляющие свободной энергии образования. Например, взаимодействие между молекулами растворителя, окружающими цепь, может изменить наиболее вероятную ориентацию, характерную для чисто энтропийного рассмотрения.
При контакте низкомолекулярных жидкостей с поверхностью раздела фаз также должны наблюдаться как дополнительная диссоциация ассоциированных соединений, так и ориентация неассоциированных молекул, так как сохраняются причины возникновения данных процессов. Расчет избыточной энтропии расположения молекул на поверхности, в отличие от избыточной энтропии смешения молекул различных размеров в растворах, проводится в двух, а не в трех измерениях. Ясно, что при количественной оценке наблюдаемых процессов нужно учитывать все составляющие свободной энергии, влияющие на эти процессы.
Рассмотрим влияние длины цепи и других параметров на процессы дополнительной диссоциации и ориентации.
При изменении молекулярной массы цепи при
постоянном количестве исходных молекул (в
пересчете на неассоциированные молекулы) и
постоянных внешних условиях возрастает (по
абсолютной величине) избыточная свободная
энергия смешения молекул различных размеров, а
следовательно, должна увеличиваться
дополнительная диссоциация и ориентация молекул
НМС. На рис. 1![]() представлена
зависимость предельного коэффициента
активности растворителя (
представлена
зависимость предельного коэффициента
активности растворителя (![]()
![]() ) от соотношения r1/r2,
взятая из работы [8]. Ясно,
что увеличения степени диссоциации не будет
наблюдаться до тех пор, пока не будет достигнуто
значение избыточной свободной энергии,
достаточное для дополнительного разрыва
ассоциированных молекул. Следовательно,
возникновение дополнительной диссоциации в
зависимости от молекулярной массы есть процесс
дискретный, т.е. при заданном строении цепей и НМС
и постоянных внешних условиях дополнительная
диссоциация и ориентация наблюдаются, начиная с
определенной длины (молекулярной массы (М)) цепи.
При дальнейшем увеличении М эти процессы
непрерывно возрастают, стремясь к пределу при М
) от соотношения r1/r2,
взятая из работы [8]. Ясно,
что увеличения степени диссоциации не будет
наблюдаться до тех пор, пока не будет достигнуто
значение избыточной свободной энергии,
достаточное для дополнительного разрыва
ассоциированных молекул. Следовательно,
возникновение дополнительной диссоциации в
зависимости от молекулярной массы есть процесс
дискретный, т.е. при заданном строении цепей и НМС
и постоянных внешних условиях дополнительная
диссоциация и ориентация наблюдаются, начиная с
определенной длины (молекулярной массы (М)) цепи.
При дальнейшем увеличении М эти процессы
непрерывно возрастают, стремясь к пределу при М![]()
![]() .
.
Для процессов на поверхности раздела фаз зависимости от размеров этой поверхности и от длины цепи качественно одинаковы, причем количественно зависимости от различных координат поверхности (двумерное пространство) могут различаться.
Поскольку от поперечного сечения цепи зависит количество окружающих ее молекул НМС и взаимодействие цепь - НМС, то, вероятно, процессы дополнительной диссоциации и ориентации зависят и от диаметра волокна. Эта зависимость представляет собой плавную кривую, стремящуюся к параметрам, характерным для плоской границы раздела фаз. По-видимому, процессы дополнительной диссоциации и ориентации должны проявляться и при набухании трехмерной системы.
Исходя из вышеизложенного, можно предполагать, что данные процессы зависят не только от координат (размеров) n-мерного (n = 1, 2, 3) пространства, но и от их формы (n = 1 - полимер (цепь), n = 2 - поверхность, n = 3 - сетка).
С ростом температуры в предположении о
постоянстве других параметров системы
составляющие свободной энергии, обусловленные
комбинаторными членами (свободные энергии
идеального смешения и смешения молекул
различных размеров), должны линейно возрастать
(по абсолютной величине). В реальных условиях при
повышении температуры уменьшаются энергии
взаимодействия ассоциат - ассоциат и цепь - НМС.
Это должно привести к более чем линейному
возрастанию степени дополнительной диссоциации.
Очевидно, что существуют минимальная
температура, выше которой НМС полностью
диссоциировано, и максимальная температура, ниже
которой дополнительная диссоциация НМС не
наблюдается. Следовательно, зависимость степени
диссоциации ассоциированного растворителя (![]() ) от температуры в присутствии цепных
молекул или поверхности раздела фаз имеет
S-образный вид (рис.
2
) от температуры в присутствии цепных
молекул или поверхности раздела фаз имеет
S-образный вид (рис.
2![]() ).
).
Так как обычно обработка текстильных материалов ведется в присутствии растворителя, то необходимо учитывать, что концентрации веществ в объеме и вблизи поверхности раздела фаз и/или цепных молекул могут различаться. Пример оценки концентрации НМС и его ассоциированной формы в объеме и вблизи цепи по экспериментальным данным приведен в работе [1]. Вследствие того, что дополнительная диссоциация и ориентация обусловлена только НМС, находящимися вблизи цепи или поверхности раздела фаз, то чем выше взаимодействие ассоциата с цепью, тем меньше выражены данные процессы. С ростом концентрации НМС количество молекул, окружающих цепь, увеличивается, и в пределе цепи окружаются только НМС.
Чем сильнее взаимодействие между молекулами в ассоциате, тем слабее при прочих равных условиях выражена дополнительная диссоциация.
Очевидно, что уменьшение свободной энергии образования системы за счет дополнительной диссоциации и ориентации НМС приводит к ее стабилизации, а следовательно, и к стабилизации отдельных компонентов системы.
Использование данных явлений в текстильной химии было начато с процесса беления хлопчатобумажных тканей [9]. Предварительно был решен вопрос о стабилизации пероксида водорода добавками полиэтиленгликоля. В результате предложен и реализован на практике бессиликатный метод перекисного беления текстильных материалов, интенсифицирующий процесс в 1,5-2 раза и улучшающий показатели качества текстильных материалов (капиллярность, степень белизны) [10].
Существенная стабилизация пероксида водорода была достигнута при добавках линейных (полиэтиленгликоль, поливиниловый спирт) и трехмерных (катиониты КУ-2х8, КБ-4П2) полимеров [11]. К сожалению, другие направления использования описанных процессов в текстильной химии автору неизвестны, хотя очевидно, что они имеют более широкое значение. Например, данные процессы необходимо учитывать при анализе пропускания влаги через ткани.
Естественно, эти процессы должны учитываться и быть использованы и в других процессах, например, в катализе [12], мембранных технологиях, которые так или иначе связаны с производством, переработкой и использованием текстильных изделий.
![]()